Inleiding
In de media is regelmatig aandacht voor specifieke bijwerkingen van geneesmiddelen. Niet zelden geeft dit aanleiding tot groeiende ongerustheid onder patiënten. Ook is er een maatschappelijke trend dat mensen risico’s steeds minder accepteren. Hoe gaat u daarmee om als huisarts of apotheker? Op basis van welke bronnen geeft u uw patiënten geschikte informatie? In deze FTO-publicatie krijgt u inzicht in het herkennen van bijwerkingen en weet u welke rol u heeft in de bewaking van een veilig gebruik van geneesmiddelen.
Werking en bijwerking van een geneesmiddel zijn onlosmakelijk met elkaar verbonden. Veel bijwerkingen zijn bekend en opgenomen in de officiële productinformatie, te vinden op de website van het College ter Beoordeling van Geneesmiddelen (CBG, www.geneesmiddeleninformatiebank.nl). Deze informatie beperkt zich tot frequenties waarin deze bijwerkingen optraden in klinische onderzoeken, aangevuld met gegevens uit post-marketing surveillance onderzoek.
Voordat een geneesmiddel of een vaccin op de markt wordt toegelaten, wordt het uitvoerig getest op effectiviteit en veiligheid. Toch is de informatie over bijwerkingen op dat moment nog beperkt. Klinische studies zijn meestal niet ingericht om bijwerkingen of risico’s op te sporen die weinig voorkomen, of die pas na langdurig gebruik optreden. Daarbij komt nog, dat tijdens studies de geneesmiddelen worden onderzocht in een streng geselecteerde populatie. In de praktijk zullen vooral ouderen en patiënten met meerdere ziekten en bijkomend geneesmiddelgebruik de geneesmiddelen gebruiken.
Hoe vaak bijwerkingen optreden, is niet precies bekend en hangt ook sterk af van het betreffende geneesmiddel en de setting waarin het wordt gebruikt. Ongeveer 5% van alle niet-geplande ziekenhuisopnames wordt veroorzaakt door een bijwerking. Binnen het ziekenhuis krijgt gemiddeld 17% van de patiënten te maken met bijwerkingen, die soms aanleiding geven tot verlenging van de opname, of tot staken van de therapie.1
Het risico op bijwerkingen neemt toe naarmate meer geneesmiddelen tegelijkertijd worden gebruikt. Dit effect is sterker dan de optelsom van het risico per geneesmiddel, en hangt ook samen met interacties tussen geneesmiddelen en gerelateerde ziekten.2 Goldberg (1996) stelde vast dat het risico op een bijwerking bij twee geneesmiddelen 13% bedroeg, maar dat oudere patiënten die zeven of meer geneesmiddelen gebruikten een risico van 82% hadden op bijwerkingen.3
Onderzoeken medicatieveiligheid
Het aantal geneesmiddel gerelateerde ziekenhuisopnamen is bij ouderen viermaal zo groot als bij volwassenen van 18-65 jaar. Bij ouderen is de helft van de geneesmiddel gerelateerde ziekenhuisopnamen potentieel vermijdbaar. Dit blijkt uit de verschillende onderzoeken naar medicatie gerelateerde ziekenhuisopnames die tussen 2003 en 2013 in Nederland zijn uitgevoerd, waarvan in januari 2017 een samenvattend eindrapport is verschenen.4
Tabel 1 Redenen voor potentieel vermijdbare medicatiegerelateerde ziekenhuisopnames en de daarbij geassocieerde geneesmiddelen.4
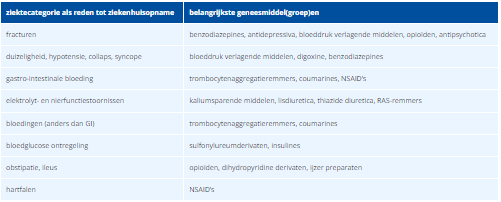
De hier beschreven bijwerkingen zijn veelal bekende risico’s van betreffende geneesmiddelen. Toch blijkt het in de praktijk lastig om deze bijwerkingen te voorkómen. Onvoldoende rekening houden met patiëntgebonden factoren voor de keuze van een geneesmiddel, dosering of toedieningsweg blijkt een belangrijke oorzaak hiervoor te zijn. Maar ook reeds bekende overgevoeligheid, interacties tussen geneesmiddelen of onvoldoende controle zijn oorzaken voor de geneesmiddel gerelateerde ziekenhuisopnames.
De multidisciplinaire richtlijn ‘Polyfarmacie bij ouderen’ en de publicatie ‘Polyfarmacie’ op FTO-Online geven praktische handvatten om farmacotherapie te optimaliseren en de last van bijwerkingen te beperken. Het alert zijn op mogelijke bijwerkingen en deze tijdig herkennen is belangrijk in het vermijden van ernstige gevolgen van bijwerkingen of medicatiegerelateerde problemen.
Casuïstiek
1
Casus I – Misselijk en verward
1.1
Een 83-jarige vrouw wordt opgenomen op de intensive care vanwege hartritmestoornissen, bewustzijnsverlies en convulsies. Haar echtgenoot geeft aan dat ze al langere tijd last had van vermoeidheid, verwardheid, een verminderde eetlust en misselijkheid met af en toe braken. De patiënte gebruikt acenocoumarol, allopurinol, bumetanide en pantoprazol. Bij aanvullend onderzoek wordt een hypomagnesiëmie vastgesteld.
In deze casus kan de hypomagnesiëmie verschillende oorzaken hebben. Zo kan de verminderde inname van voeding en het braken een rol spelen.5 Het is echter van groot belang om ook kritisch te kijken naar de medicatie als oorzaak voor de hypomagnesiëmie.
1. Van welk(e) geneesmiddel(len) zou de hypomagnesiëmie een bijwerking kunnen zijn? (Meerdere goede antwoorden zijn mogelijk):
A. Acenocoumarol
B. Een interactie tussen pantoprazol en bumetanide
C. Een interactie tussen bumetanide en acenocoumarol
D. Pantoprazole
Controleer uw antwoord

Antwoordopties B (een interactie tussen pantoprazol en bumetanide) en D (pantoprazol) zijn juist.
De oorzaken voor hypomagnesiëmie kunnen grofweg in twee groepen verdeeld worden: verlies van magnesium via het maag-darmkanaal en verlies van magnesium via de nieren. Het is bekend dat zowel gebruik van lis- en thiazidediuretica, als langdurig gebruik van protonpompremmers kan leiden tot hypomagnesiëmie.6 Hypomagnesiëmie kan op zichzelf weer leiden tot hypoparathyroïdisme, hypocalciëmie en hypokaliëmie.7,8
1.2
2. Wat verwacht u ten aanzien van de kans op het ontwikkelen van een hypomagnesiëmie wanneer zowel een lis- of thiazide diureticum als een protonpompremmer wordt gegeven?
Controleer uw antwoord

Co-administratie van hypomagnesiëmie-inducerende geneesmiddelen kunnen een additief effect hebben.25 Tot op heden beschrijven slechts enkele studies een verhoogde kans op hypomagnesiëmie bij gelijktijdig gebruik van protonpompremmers en diuretica.8,26
Actualiteit
Veneuze trombose bij ethinylestradiol en cyproteron (Diane-35®)
In 2013 ontstond ophef over het risico op trombo-embolieën, met mogelijk fatale gevolgen, bij gebruik van ethinylestradiol-cyproteron (Diane-35®). Hoewel dit verhoogde, maar kleine, risico bekend was, bleek het aantal vrouwen met ernstige bijwerkingen groter dan aanvankelijk was ingeschat. Onder andere het off-label gebruik van ethinylestradiol-cyproteron als anticonceptivum heeft hieraan bijgedragen. Naar aanleiding hiervan is de indicatie aangescherpt en is het middel uitsluitend nog bedoeld voor de behandeling van ernstige acne.9
Bijwerkingen als gevolg van generieke substitutie10
Regelmatig worden problemen geconstateerd die voortkomen uit het substitueren van geneesmiddelen. Gezondheidsklachten als gevolg van substitutie van geneesmiddelen zijn niet altijd eenvoudig te verklaren. Voor generieke substitutie gelden de richtlijnen voor bio-equivalentie. De biologische beschikbaarheid van twee geneesmiddelen met dezelfde werkzame stof en dosering moet binnen acceptabele grenzen liggen van 80-125%. Voor geneesmiddelen met een smalle therapeutische breedte is de grens 90-111%. Voor een aantal geneesmiddelen, zoals schildkliermedicatie en anti-epileptica, is afgesproken dat switchen tussen fabrikanten dient te worden vermeden. Hulpstoffen zijn zelden de oorzaak van bijwerkingen na geneesmiddelsubstitutie. Verschillen in biologische beschikbaarheid en afgifte van werkzame bestanddelen zijn een meer aannemelijke oorzaak. Daarnaast spelen ook psychische effecten een rol.
Bijzondere aandacht is er voor substitutie van biologicals, de biosimilars, die niet identiek zijn aan het referentiepreparaat. Omdat van een aantal biologicals het patent verloopt, komen steeds meer biosimilars op de markt. Substitutie van deze middelen wordt afgeraden.11
Door het melden van dergelijke problemen, bijvoorbeeld in situaties waarin substitutie niet gewenst of onvermijdelijk is, kan Bijwerkingencentrum Lareb snel signaleren waar problemen ontstaan. Enkele voorbeelden van product- en substitutie gerelateerde klachten zijn:
-
Thyrax® en levothyroxine12,13
Vanwege een smalle therapeutische breedte ontstaan bij een geringe wijziging in de dosering klachten die kunnen passen bij hypo- of hyperthyreoidie. Door de verpakkingswijziging van Thyrax® in 2015, en door gedwongen substitutie door onvoldoende beschikbaarheid in 2016, kregen veel patiënten klachten. Vooral mensen die een dosering van 100 microgram levothyroxine of meer gebruikten, kregen klachten die niet in alle gevallen geobjectiveerd konden worden met veranderingen in labwaarden.
-
verminderde werkzaamheid van inhalers, ondanks dat er geen productdefecten zijn aangetroffen, zoals:
-
salbutamol aerosol van Sandoz, sinds de verandering van de inhalator14
-
salmeterol/fluticason van Vincion® en Focus® 15
Het is belangrijk om patiënten goed te begeleiden bij substitutie en om op eventuele wijzigingen in het product te letten en zonodig aanvullende instructies te geven.
Risicovolle stoffen in voedingssupplementen
Ook vrij verkrijgbare middelen hebben risico’s. Voedingssupplementen, zoals libidoverhogers, afslankpreparaten en ‘pre-work-out-producten’ kunnen risicovolle stoffen bevatten die aanleiding geven tot potentieel ernstige bijwerkingen. In een onderzoek van de NVWA (Nederlandse Voedsel en Waren Autoriteit) uit 2016 bleek dat een groot aantal voedingssupplementen niet-gedeclareerde farmacologisch actieve stoffen zoals sildenafil, sibutramine, amfetamine-achtige stoffen bevat.16 Bij Lareb kunnen ook vermoede bijwerkingen van niet geregistreerde middelen en voedingssupplementen worden gemeld.
Kijk voor actuele kwesties over bijwerkingen ook op www.lareb.nl.
Bijwerkingen herkennen
De World Health Organisation (WHO) definieert een bijwerking als:
"A side effect is a harmful and/or unintended effect that accompanies the use of a drug in a usual dose for prevention, diagnosis or treatment of a disease or condition."
Definitie ‘bijwerking' van World Health Organisation (WHO).17
Er bestaan verschillende typen bijwerkingen. Een globale indeling van bijwerkingen helpt om de achtergrond ervan te begrijpen en geeft richting aan het beleid voor verdere behandeling. Een veel gebruikte indeling is die van type A t/m F (zie tabel 2). Het belangrijkste onderscheid is daarbij het mechanisme waarop de bijwerking ontstaat, namelijk een farmacologisch effect (type A) of op basis van overgevoeligheid (type B). Een ander belangrijk aspect is de tijdsrelatie, waarmee de bijwerkingen na langdurig gebruik (type C) en met een vertraagd ontstaansproces (type D) worden aangeduid. Grofweg zijn bijwerkingen onder te verdelen in zes typen.
Tabel 2 Typen bijwerkingen.18

De type B bijwerkingen worden aangeduid als overgevoeligheid, die zowel allergisch als niet-allergisch van aard kan zijn. Zie ook figuur 1.
Allergische overgevoeligheid
Overgevoeligheid op basis van een allergie, berust op betrokkenheid van het immuunsysteem. Alle typen allergieën volgens de indeling van Gell en Coombs kunnen voorkomen bij geneesmiddelovergevoeligheid, zie figuur 1. Kenmerkend voor overgevoeligheden is dat een sensibilisatieperiode vereist is, variërend van dagen tot enkele weken. Bij vervolgtoedieningen treedt de reactie snel op: bij een type I allergie binnen minuten tot uren, en bij een type IV allergie binnen 1 dag.
Figuur 1 Type B bijwerkingen.18
G6PD: glucose-6-fosfaatdehydrogenase; SJS: Stevens-Johnson-syndroom; TEN: toxische epidermale necrolyse.
Niet-allergische overgevoeligheid
Bij niet-allergische overgevoeligheid lijkt er sprake van een allergische reactie, maar is het immuunsysteem niet betrokken! Klachten kunnen al ontstaan na een eerste toediening, maar ook later in de behandeling. Bij een pseudo-allergie is er sprake van een farmacologisch effect, waarna klachten ontstaan die lijken op een allergie. Bij een idiosyncratische reactie heeft de patiënt een onbegrepen of genetische aanleg om op bepaalde geneesmiddelen overgevoelig te reageren. Een specifiek voorbeeld is hemolytische anemie bij gebruik van nitrofurantoïne.
Op basis van symptomen is het niet altijd mogelijk om onderscheid te maken tussen allergische en niet-allergische overgevoeligheid. Bijvoorbeeld: iemand kan allergisch zijn voor één specifiek NSAID, of iemand kan overgevoelig zijn voor de gehele groep NSAID’s en salicylaten. Dit voorbeeld laat zien dat het van belang is om het onderliggend mechanisme na te gaan, zodat het toekomstig beleid hierop afgestemd kan worden.
Casuïstiek - vervolg
2
Casus II – Tandenknarsen
Casus III – Zwelling in het gelaat
2.1
Een vrouw van 68 jaar heeft last van pijnlijke enkelgewrichten. U schrijft haar diclofenac 50 mg voor, 3 maal daags 1 tablet. Na twee dagen treedt zwelling op van ogen en lippen. Ook is ze kortademig. In haar jeugd heeft zij astma gehad. Na het stoppen van diclofenac herstellen de klachten gelukkig weer.
Figuur 3 Zwelling van de lip.
1. Wat is hier mogelijk aan de hand?
Controleer uw antwoord

-
Astma-exacerbatie door NSAID
-
Allergische reactie met angio-oedeem (type 1, IgE gemedieerd) op diclofenac
-
Overgevoeligheidsreactie (pseudo-allergisch van aard) door NSAID
2.2
Een jaar later slikt zij tijdens een verblijf in het buitenland ibuprofen wegens hoofdpijn. Na enkele uren treedt weer zwelling op van lippen en ogen, zij het in iets lichtere mate dan voorheen.
2. Wat is nu uw diagnose?
Controleer uw antwoord

Waarschijnlijk een pseudo-allergische reactie op verschillende NSAID’s. Ibuprofen en diclofenac zijn structureel niet verwant en kruisovergevoeligheid op basis van een immunologische overgevoeligheidsreactie is niet te verklaren. Bij een allergie op basis van een immunologisch mechanisme bestaat overgevoeligheid voor een specifiek NSAID of structureel verwante NSAID’s.
2.3
3. Wat adviseert u met betrekking tot het gebruik van NSAID’s?
Controleer uw antwoord

Een pseudo-allergische reactie door NSAID’s wordt veroorzaakt door een farmacologisch effect. Het betreft een niet-allergische overgevoeligheid.
Door remming van COX-1 enzymen wordt de omzetting van arachidonzuur in prostaglandines geremd. Daardoor is er meer arachidonzuur beschikbaar voor de 5-lipoxygenase route waaruit leukotriënen worden gevormd. Onder andere LTE4 kan leiden tot vasodilatatie en aanleiding geven tot (angio)oedeem. Van de prostaglandines remt het PGE2 normaal gesproken de vrijzetting van histamine uit mestcellen. Bij gebrek aan PGE2 kan dit ook leiden tot een grotere kans op angio-oedeem. Omdat alle niet selectieve NSAID’s op basis van hetzelfde farmacologische effect, in daarvoor gevoelige personen, eenzelfde reactie kunnen veroorzaken, zijn alle NSAID´s gecontra-indiceerd voor toekomstig gebruik. Paracetamol en COX2 selectieve NSAID´s worden door de meeste patiënten dan wel goed verdragen.29
Figuur 4 Mechanisme NSAID’s gerelateerd angio-oedeem.23
NSAID’s: niet-steroïde anti-inflammatoire geneesmiddelen; COX: Cyclo-oxygenase; PGG2: Prostaglandine G2; PGH2: Prostaglandine H2; PGD2: Prostaglandine D2; PGF2a: Prostaglandine F2a; PGI2: Prostaglandine I2 (prostacycline); TXA2: Tromboxaan A2; PGE2: Prostaglandine E2; 5-HPETE: 5-hydroperoxy-eicosatetraeenzuur; LTA4: Leukotriene A4; LTC4: Leukotriene C4; LTD4: Leukotriene D4; LTE4: Leukotriene E4; LTB4: Leukotriene B4; FLAP: 5-lipoxygenase-activerend proteïn; 5-lipoxygenase.
2.4
4. Hoe kan een allergische reactie worden onderscheiden van een pseudo-allergische reactie?
Controleer uw antwoord

Op basis van symptomen en de ernst van de reactie is het niet mogelijk om onderscheid te maken tussen een overgevoeligheidsreactie van allergische aard of een pseudo-allergische reactie. Bij een allergische reactie waarbij angio-oedeem en urticaria en bronchoconstrictie kunnen optreden (type I, IgE gemedieerd), is sensibilisatie vereist. Bij een eerste blootstelling kan sensibilisatie optreden, hoewel dit zich niet altijd uit in klachten. Veelal ontstaan de klachten kort na inname van de laatste dosis of bij een volgende keer na een langere tussenpoos dat het NSAID wordt ingenomen. De klachten kunnen binnen enkele minuten tot uren optreden. Indien iemand op verschillende NSAID’s urticaria, angio-oedeem of dyspneu ontwikkelt, is er wellicht sprake van een pseudo-allergische reactie. Deze kunnen zich ontwikkelen in uren. Bij twijfel kan allergologisch onderzoek behulpzaam zijn.24
Risicogroepen en risicofactoren
Elk individu dat een geneesmiddel gebruikt, loopt een potentieel risico op het krijgen van een bijwerking. Wie last krijgt van bijwerkingen is niet van te voren te voorspellen. Sommige patiëntengroepen lopen echter wel een verhoogd risico op het krijgen van een bijwerking of een verhoogd risico op een ernstig beloop van bijwerkingen. Zo is uit onderzoek van Leendertse et al. gebleken dat patiënten die vijf of meer geneesmiddelen chronisch gebruiken, een twee keer zo hoog risico hebben op een bijwerking-gerelateerde ziekenhuisopname.19 Ook is bekend dat het risico op bijwerkingen toeneemt met de leeftijd als gevolg van leeftijdsgerelateerde veranderingen in farmacokinetiek en -dynamiek en het aanwezig zijn van comorbiditeit en polyfarmacie.2 Genetische factoren spelen ook vaak een rol bij het ontstaan van bijwerkingen. Verschillende geneesmiddelen worden gemetaboliseerd door het cytochroom-P450-enzymsysteem in de lever. Een aantal patiënten heeft een aangeboren verminderde of juist verhoogde werkzaamheid van dit enzymsysteem waardoor geneesmiddelen vertraagd, dan wel versneld omgezet worden. Afhankelijk van het feit of de stof zelf of één van zijn metabolieten farmacologisch actief is, kan dit aanleiding geven tot een verhoogde kans op het optreden van bijwerkingen.20
Oorzakelijk verband
Indien een patiënt zich presenteert met een klacht, moet men het identificeren van een bijwerking als oorzaak van de klacht zien als onderdeel van het totale diagnostische proces. Wanneer een patiënt geneesmiddelen gebruikt, dienen bijwerkingen dus ook in de differentiaal diagnose opgenomen te worden. Het is vaak lastig om erachter te komen welke geneesmiddelen een patiënt gebruikt. Patiënten zien vrij verkrijgbare geneesmiddelen, kruidenpreparaten (zoals sint-janskruid), multivitaminen en drugs vaak niet als medicatie. Ook geneesmiddelen die langdurig gebruikt worden, zoals orale anticonceptiva, worden soms niet gezien als medicatie.
Wanneer duidelijk is welke geneesmiddelen een patiënt gebruikt, kan bekeken worden of de klacht veroorzaakt kan zijn door een geneesmiddel. Als de patiënt verschillende geneesmiddelen gebruikt, is het lastig te bepalen of en welk geneesmiddel de oorzaak is. Dit is een complex probleem, omdat sommige klachten kunnen worden veroorzaakt door andere ziekten of door één of meer van de geneesmiddelen.
Figuur 5 BAT-M.
Om de sterkte van een causaal verband tussen de klacht en een geneesmiddel te kunnen beoordelen, is het van belang om de volgende factoren in de beoordeling mee te nemen:
Bekend
De aanwezigheid van een eerdere beschrijving van een causale relatie tussen de klacht en het geneesmiddel. Een eerdere beschrijving in de literatuur van een mogelijke relatie, leidt tot een sterke causaliteit.
Andere oorzaken
De aanwezigheid van factoren die een rol gespeeld kunnen hebben bij het ontstaan van de klachten. Indien andere factoren aanwezig zijn, leidt dit tot een minder sterke causaliteit.
Tijdsrelatie
De latentietijd (de tijd tussen de start van het geneesmiddel en het optreden van de klachten)
Indien de latentietijd past bij de farmacokinetiek en -dynamiek van het geneesmiddel, draagt dit bij aan de sterkte van de causale relatie.
Een positieve dechallenge en/of rechallenge
Indien de bijwerking verdwijnt bij staken van het geneesmiddel, is er sprake van een positieve dechallenge. De tijd tussen staken van het verdachte middel en volledig herstel van de patiënt is afhankelijk van de farmacodynamische en -kinetische eigenschappen van een geneesmiddel evenals het onderliggende pathofysiologisch mechanisme van de bijwerking. Zo zal de hersteltijd van een geneesmiddelgeïnduceerde neuropathie langer zijn dan die van geneesmiddelgeïnduceerde diarree. Over het algemeen verergeren geneesmiddelgeïnduceerde klachten niet na staken van het verdachte middel en nemen ze (langzaam) in ernst af. Men spreekt van een positieve rechallenge als de bijwerking opnieuw optreedt bij het hervatten van het gebruik van het geneesmiddel. Een positieve de- en rechallenge ondersteunen een causale relatie.
Mechanisme
De aanwezigheid van een verklarend farmacologisch mechanisme. Een verklarend farmacologische mechanisme ondersteunt een causale relatie.
In figuur 5 zijn bovenstaande factoren (BAT-M) op een eenvoudige manier gevisualiseerd.
Casuïstiek - vervolg
3
Casus IV – Gevoelsstoornissen
Casus V - Malariaprofylaxe en depressiviteit
3.1
Een vrouw van 56 jaar gebruikt sinds 3 dagen 1x daags 250 mg atovaquon en 100 mg proguanilhydrochloride voor malaria profylaxe. Na 3 dagen krijgt zij last van depressiviteit, huidirritatie en aften in de mond. Zij heeft al eens eerder atovaquon/proguanil geslikt, zonder problemen. Direct na het optreden van de verschijnselen wordt de medicatie gestaakt. De depressiviteit en de huidirritatie zijn een dag na staken verdwenen. De aften in de mond zijn 14 dagen na staken verdwenen.
1. Is hier sprake van een bijwerking? Zo ja, van welke type?
Controleer uw antwoord

Depressiviteit, pruritus en rash als ook stomatitis kunnen een bijwerking zijn van gebruik van atovaquon/proguanil bij behandeling en profylaxe van malaria. Een mechanisme voor deze bijwerkingen is niet bekend. Desondanks zijn het frequent voorkomende bijwerkingen. Er is dus sprake van een type A bijwerking.
Argumenten tegen een bijwerking zijn: er is geen farmacologisch mechanisme bekend wat de relatie ondersteunt, er zijn ook mogelijke andere factoren zoals een verminderde afweer, geneesmiddel allergie en eventueel een voorgeschiedenis van depressieve klachten die de bijwerkingen hebben kunnen veroorzaakt, ondanks dat de patiënt deze niet heeft benoemd.
Bovenstaande casus illustreert dat ook bij gebruik van atovaquon/proguanil bijwerkingen van psychische aard op kunnen treden. In de praktijk wordt atovaquon/proguanil veelal verkozen boven mefloquine, aangezien mefloquine meer bekend staat om bijwerkingen als hallucinaties, depressiviteit en suïcidale neigingen. Het is van belang om patiënten te informeren over het feit dat dergelijke bijwerkingen ook bij gebruik van andere antimalaria middelen op kunnen treden. Hoewel een rol door de geneesmiddelen zeker niet kan worden uitgesloten, lijken omgevingsfactoren zoals stress door een veranderende leefomgeving en de reis ook een rol te spelen. Neuropsychiatrische klachten die voor kunnen komen bij gebruik van mefloquine zijn onder andere duizeligheid, depressie, nachtmerries en hallucinaties, psychotische klachten, angstaanvallen.36,37
3.2
2. Welke argumenten spelen een rol bij het vaststellen van een oorzakelijk verband van een bijwerking?
Controleer uw antwoord

Bij het beoordelen van een oorzakelijk verband van een bijwerking kan rekening gehouden worden met de BAT-M.
B: is de bijwerking bekend?
A: welke andere factoren spelen een rol of kunnen uitgesloten worden?
T: is er een plausibele tijdsrelatie?
M: is er een ondersteunend farmacologisch mechanisme?
In deze casus pleiten de volgende aspecten voor een bijwerking:
-
de klachten zijn bekend bij de combinatie atovaquon/proguanil
-
de tijdsrelatie van 3 dagen na starten is plausibel
-
het herstel van de klachten na staken van de verdachte medicatie (dechallenge) versterkt het causaal verband
Een bijwerking melden
Zorgverleners en farmaceutische bedrijven hebben de verantwoordelijkheid om bijwerkingen te melden, om de veiligheid van het gebruik van geneesmiddelen in de praktijk te bewaken. In de geneesmiddelenwet is sinds 2007 de verplichting voor artsen en apothekers vastgelegd om ernstige bijwerkingen te melden.21 Voor het melden van een bijwerking is geen aparte toestemming van de patiënt nodig. Wel voelen patiënten zich serieus genomen als u hun bijwerking meldt. Patiënten mogen overigens ook zelf bijwerkingen melden. Meldingen van patiënten en zorgverleners vullen elkaar aan in de geboden informatie.
Kader 1 Ernstige bijwerkingen; criteria van de Council for the Organisation of Medical Sciences (CIOMS)
Ernstige bijwerkingen zijn bijwerkingen die leiden tot:
-
overlijden
-
levensbedreigende situatie
-
(verlenging van) ziekenhuisopname
-
blijvende invaliditeit of arbeidsongeschiktheid
-
aangeboren afwijkingen
Waarom melden?
Het melden van bijwerkingen uit de praktijk is belangrijk, om meer kennis over bijwerkingen beschikbaar te maken voor de praktijk. Hieruit vloeit voort dat nog onbekende bijwerkingen kunnen worden opgespoord, maar ook dat kennis over reeds bekende bijwerkingen toeneemt. Er is bijvoorbeeld vrij weinig bekend over tijdsrelaties waarin bijwerkingen optreden, of een bijwerking reversibel is, welke hersteltijd men kan verwachten na het stoppen met het verdachte geneesmiddel en welke risicofactoren mogelijk een rol spelen.
Wat melden?
Het is praktisch niet mogelijk om alle bijwerkingen die u in de praktijk tegenkomt, te melden. In tabel 3 wordt weergegeven welke gegevens van belang zijn wanneer u een bijwerking wilt melden. Meldt u vooral datgene waarvan u vindt dat het belangrijk is voor collega’s of patiënten om te weten. Alle (vermoede) bijwerkingen van geneesmiddelen en vaccins kunnen worden gemeld, maar ook van kruidenpreparaten, vitaminen, supplementen en andere gezondheidsproducten die geen geregistreerd geneesmiddel zijn.
Kader 2 Wat melden?
Meld die bijwerkingen waarvan u vindt dat uw collega's en/of patiënten het zouden moeten weten. Dat kunnen vermoedens van potentiële nieuwe bijwerkingen zijn, maar het kan ook gaan om bijzondere aspecten van bekende bijwerkingen, zoals de ernst, het beloop, of bijvoorbeeld het risico van het niet herkennen ervan in de praktijk.
Figuur 8 Zwarte driehoek.
Met deze zwarte driehoek wordt aangegeven dat het geneesmiddel is onderworpen aan additionele monitoring.22 Dit geldt voor veel nieuwe geneesmiddelen. Dit betekent ‘Let op, meld alle vermoede bijwerkingen bij Bijwerkingencentrum Lareb’.
Kader 3 Voorbeeld van nieuwe informatie uit meldingen over een bekende bijwerking
Een bekende bijwerking van ACE-remmers is angio-oedeem. De productinformatie van bijvoorbeeld enalapril vermeldt dat dit een vaak voorkomende bijwerking betreft.23 Onder andere op basis van meldingen aan bijwerkingencentra wereldwijd is verder nog bekend geworden dat angio-oedeem gedurende de gehele behandeling kan optreden, zowel aan het begin binnen enkele uren als na jaren gebruik. Bij de meeste patiënten verloopt de bijwerking mild en herstellen de klachten na staken, er zijn echter ook fatale gevallen gemeld.24
Hoe meldt u een mogelijke bijwerking?
Op de volgende manieren kunt u een bijwerking melden:
-
-
via de Bijwerkingen app, beschikbaar voor iOS en Android
-
via het papieren meldformulier uit het Farmacotherapeutisch Kompas
-
voor huisartsen: via NHG-doc kunt u instellen of u een bijwerking wilt melden bij het invoeren van een bijwerking in uw HIS. Daarbij wordt een vooraf ingevuld meldformulier met de reeds beschikbare gegevens getoond en hoeft u de gegevens alleen nog te controleren en zo nodig aan te vullen.
-
door het opsturen van een (geanonimiseerde) ontslagbrief, indien daarin een bijwerking uitvoerig is omschreven. Dit kan dienen als aanvulling op een melding of gebruikt worden als melding.
Tabel 3 Welke informatie is nuttig in een melding?

NB. De minimaal verplichte informatie is vetgedrukt. De andere gegevens zijn, indien beschikbaar, van belang om door te geven, zodat een goede beoordeling van de melding kan plaatsvinden.
Casuïstiek - vervolg
4
Casus VI – Uitgebreide zwelling en roodheid van de arm
4.1
Een 3-jarig meisje krijgt haar vijfde DKTP-vaccinatie. Twee dagen na de vaccinatie krijgt het meisje last van uitgebreide zwelling van de gevaccineerde bovenarm. De arm kleurt vurig rood en jeukt. Deze reactie is zo groot dat deze rondom de bovenarm en over de elleboog heen gaat. Haar moeder beschrijft het alsof een band strak om de arm getrokken is. Het meisje is moe en hangerig, maar heeft geen koorts. Vijf dagen na vaccinatie neemt de zwelling zichtbaar af en twee dagen later is het meisje bijna volledig hersteld.
1. Wat is uw diagnose?
Controleer uw antwoord

Diagnose: De hier gemelde verschijnselen passen bij de uitgebreide vorm van een lokale ontstekingsreactie, ‘extensive limb swelling’ (ELS).
Toelichting: na elke vaccinatie kunnen lokale reacties op de injectieplaats ontstaan. Het betreft meestal klassieke ontstekingsverschijnselen zoals roodheid, warmte, zwelling en pijn. Onderzoeken laten zien dat 19,3% tot 33% van de kinderen na hun booster DKTP-vaccinatie op 4-jarige leeftijd een uitgebreide lokale ontstekingsreactie krijgen (roodheid en/of zwelling met een diameter van 50 mm of groter). 1% tot 2% ontwikkelt een extensieve zwelling die zich van de schouder tot de elleboog uitbreidt. De eerste ontstekingsverschijnselen worden vaak al enkele uren na de vaccinatie zichtbaar en nemen veelal in de daaropvolgende 24 tot 48 uur in hevigheid toe. Vervolgens verdwijnen deze verschijnselen weer spontaan binnen een week. Pijn en gevoeligheid op de injectieplaats kan in het begin aanwezig zijn, maar neemt af naarmate de reactie zich in grootte uitbreidt. Bewegingsbeperking en systemische verschijnselen zoals koorts zijn veelal niet aanwezig. De precieze pathogenese is niet duidelijk, maar cellulaire immuniteit tegen vaccin antigenen zouden bij kunnen dragen aan dit type reactie.
Differentiaal diagnostisch kan gedacht worden aan een bacteriële cellulitis. Dit gaat echter vaak gepaard met hoge koorts en algeheel ziek zijn van het kind.38
4.2
2. Zou u dit beeld behandelen? Zo ja, welke behandeling zou u inzetten?
Controleer uw antwoord

Uit meldingen bij Lareb blijkt dat bij ELS meestal geen sprake is van een infectie of allergische reactie. In vrijwel alle gevallen herstelt dit beeld zonder behandeling met antibiotica of antihistaminica.
4.3
3. Hoe sterk acht u het causale verband tussen de DKTP-vaccinatie en de symptomen waarmee het meisje zich presenteert? Licht uw antwoord toe.
Controleer uw antwoord

Zoals eerder behandeld is het voor het beoordelen van de causaliteit van belang om de vier aspecten van BAT-M na te gaan.
Het betreft in deze casus een bekende bijwerking. Ontstekingsverschijnselen op en rondom de injectieplaats komen zeer vaak voor. Diffuse zwelling van het geïnjecteerde ledemaat (ELS), in een enkel geval inclusief het aangrenzende gewricht, komt soms voor.39 Andere oorzaken dan de vaccinatie zijn voor deze lokale reactie in dit geval niet waarschijnlijk. De tijd tussen vaccinatie en het ontstaan van de klacht (latentietijd) evenals de hersteltijd maakt een causaal verband aannemelijk. Het onderliggende mechanisme voor een dergelijke heftige ontstekingsreactie na vaccinatie is niet helemaal duidelijk. Op basis van het bovenstaande kan geconcludeerd worden dat het causale verband sterk is.
Afspraken voor de praktijk
Veilig geneesmiddelgebruik
Aandacht voor bijwerkingen is een belangrijk onderdeel van de farmacotherapie. Een tijdige herkenning, behandeling en adequate vastlegging van bijwerkingen komt de individuele patiëntenzorg ten goede. Zeker in het geval van type B bijwerkingen, allergieën of overgevoeligheden voor een bepaald geneesmiddel of een bepaalde geneesmiddelengroep, is nauwkeurige documentatie van groot van belang om potentieel ernstige reacties te voorkomen. Ook voor type A bijwerkingen is nauwkeurige vastlegging van belang, om in de toekomst een goede keuze voor geneesmiddelgebruik te kunnen maken.
Enkele tips voor het vastleggen van bijwerkingen in het HIS en AIS
Beschrijf de opgetreden bijwerking/reactie zo precies mogelijk. Voor zowel u als uw collega’s moet duidelijk zijn wat er precies is gebeurd wanneer een patiënt bijwerkingen heeft ervaren na gebruik van een geneesmiddel. Om dit te achterhalen, is het van belang om de opgetreden reactie goed uit te vragen.
Let op!
Als een patiënt aangeeft allergisch te zijn voor een bepaald geneesmiddel, is het van belang na te vragen welke reactie is opgetreden. Veelal zien patiënten diarree of buikpijn bij antibioticagebruik namelijk als allergie, waarbij er mogelijk onterecht een contra-indicatie wordt ingevoerd voor dat middel.
Beschrijf eenduidig of er op basis van de opgetreden bijwerking wel of geen contra-indicatie bestaat voor het gebruik van een bepaald geneesmiddel of een bepaalde geneesmiddelengroep. Dit vergemakkelijkt de keuze voor geneesmiddelgebruik in de toekomst.
Melden van (vermoede) bijwerkingen
Zorgverleners hebben een medeverantwoordelijkheid in het bewaken van een veilig geneesmiddelgebruik in meer algemene zin. Door het melden van bijwerkingen die opvallen, kunnen nog onbekende bijwerkingen worden opgespoord en wordt de reeds bestaande kennis over bijwerkingen verrijkt.
Iedere melding van een bijwerking bij Bijwerkingencentrum Lareb wordt individueel beoordeeld en beantwoord met een inhoudelijke terugkoppeling. Meerdere meldingen kunnen de basis vormen voor een signalering of een publicatie over een bijwerking. Voorbeelden van signaleringen en publicaties en ook een overzicht van gemelde bijwerkingen kunt u vinden op www.lareb.nl.
Download ook de Bijwerkingen app voor actuele informatie over bijwerkingen en om bijwerkingen eenvoudig te kunnen melden.
Figuur 7 De Bijwerkingen app.
Lareb Intensive Monitoring
Lareb Intensive Monitoring (LIM) is een andere methode voor het verzamelen van kennis over bijwerkingen. Het is een prospectief cohort onderzoek, waarvoor patiënten zichzelf kunnen aanmelden. De apotheek kan patiënten hiervoor uitnodigen bij de eerste verstrekking van een geneesmiddel dat via LIM wordt gevolgd. De patiënt ontvangt op gezette tijden een enquête waarin gevraagd wordt naar eventuele gezondheidsklachten tijdens het gebruik van het betreffende geneesmiddel. Met deze methode is het onder andere mogelijk om incidenties van bijwerkingen te schatten en informatie te verzamelen over de tijdsrelatie en het beloop van bijwerkingen. De geneesmiddelen die in 2016 worden gevolgd, zijn de nieuwe antistollingsmiddelen, de DOAC’s apixaban, dabigatran, edoxaban en rivaroxaban. Voor meer informatie en deelnemende geneesmiddelen, zie: www.lim.lareb.nl.
Tijdens campagnes voor griepvaccinatie, maar ook bij vaccinatie tijdens een pandemie, wordt LIM toegepast om de veiligheid van vaccins te monitoren.
Naar aanleiding van het FTO worden in de FTO-groep de volgende afspraken gemaakt:



